Plan for klasselærerdagene 9.kl. d. 19.-21/9-06:
Tirsdag: Fysik/kemi forsøg
Onsdag: Tur til planetariet (betal kr. 70 til Michael senest tirsdag)
Torsdag: Fysik/kemi forsøg
|
|
Tir 8.15-9.45 |
Tir 9.45-11.00 |
Tir 11.30-13.00 |
Tor 8.15-9.45 |
Tor 9.45-11.00 |
|
Hold 1 |
Rapport nr. 1 |
Rapport nr. 2 |
Rapport nr. 3 |
Rapport nr. 4 |
Rapport nr. 5 |
|
Hold 2 |
Rapport nr. 2 |
Rapport nr. 3 |
Rapport nr. 4 |
Rapport nr. 5 |
Rapport nr. 1 |
|
Hold 3 |
Rapport nr. 3 |
Rapport nr. 4 |
Rapport nr. 5 |
Rapport nr. 1 |
Rapport nr. 2 |
|
Hold 4 |
Rapport nr. 4 |
Rapport nr. 5 |
Rapport nr. 1 |
Rapport nr. 2 |
Rapport nr. 3 |
|
Hold 5 |
Rapport nr. 5 |
Rapport nr. 1 |
Rapport nr. 2 |
Rapport nr. 3 |
Rapport nr. 4 |
Hold 1: Mehdi, Ahmad, Asraf, Ali A
Hold 2: Neba, Saba, batol
Hold 3: Majda, sara j, sara k, zahra d
Hold 4: Hoda, Zeinab, Afrah
Hold 5: Abbas, Ali S, Jafar
Placering:

Forsøg 1: Bestemmelse af syreindholdet i
Sodavand (titrering)
Problemformulering:
Hvor stort er indholdet af phosphorsyre/citronsyre i en udvalgt sodavand
?
Materialer:
Burette (50 mL),
tragt, 2 stik 250 mL bægerglas, 100 ml måleglas, pc
(pH-meter) med usb-link og pH-føler.
0,1 M NaOH-opløsning
sodavand.
Metode (udførelse):
Afmål 100 mL
sodavand og overfør dette til et 250 mL bægerglas.
Opstil titreropstillingen
Monter buretten i holderen og fyld den op
med 0,1 M NaOH-opløsning. Nulstil buretten.
Klargøring af pH-metret (pc, usblink og sensor).
Start pH-metret
Lad buretten dryppe med en frekvens på ca.
1 dråbe pr. sekund.
Mens buretten drypper
roteres bægerglasset, så opløsningen hele tiden blandes.
Hold øje med pH-metret og
luk hanen når opløsningen er neutral.
Aflæs buretten: ________
ml
Efter endt titrering skal
buretten skylles godt igennem med demineraliseret vand. Indholdet kan hældes i
vasken.

Resultatbehandling.
1) Beregn forbrug af 0,1M NaOH i ml
2) Beregn forbrug af NaOH i mol
3) Opskriv reaktionsligning for NaOH’s raktion med phosphorsyre eller citronsyre
4) Beregn hvor mange mol syre der var i opløsningen.
5) Beregn hvor mange g syre der var i opløsningen.
6) Beregn hvor mange g syre der var i hele sodavanden.
7) Sammenlign med positivlisten (se internettet)
Forsøg 2a:
Oxidation af metal
Problemformulering:
Hvordan oxiderer man et metal og får det
til at ændre sig fra metal form til ikke-metal form ?
Materialer:
Reagensglas
Magnesium 5cm
1M HCl
prop med hul til reagensglas
plastslange
sæbe
spritbrænder
plastbæger med vand
træpind
Metode (udførelse):
Fyld 5 ml 1M HCl
i et reagensglas og sæt en prop med plastikslange i reagensglasset.
Plastikslangen ledes over i et kar med sæbevand. Magnesium foldes sammen og
tilsættes til reagensglasset. Spritbrænderen tændes og sæbeboblerne antennes
med en træpind.

Resultatbehandling:
1)
Opskriv reaktionsligning for den kemiske reaktion.
Iagttag nøje den kemiske reaktion.
2)
Tegn og forklar hvordan oxidationen sker.
Forsøg 2b:
Reduktion af metal
Problemformulering:
Hvordan reducerer man et metal og får det til
at ændre sig fra ikke-metal form til metal form ?
Materialer:
Elektrolydekar
Strømforsyning
Salt (NaCl)
250 ml bægerglas
Metode (udførelse):
Fyld 100 ml demineraliseret vand i et 250
ml bægerglas. Opløs 30 g NaCl i vandet. Hæld
opløsningen i et elektrolysekar og send 6V= gennem
opløsningen.
Resultatbehandling:
1)
Iagttag den kemiske reaktion. Prøv at opsamle noget af
den luftart der dannes ved anoden(+) og se hvad der sker ved katoden(-).
2)
Opskriv den kemiske reaktionsligning ved begge
elektroder.
3)
Beskriv hvordan reduktionen foregår.
Forsøg 3:
Ammoniakfremstilling
Problemformulering:
Kan man fremstille ammoniak ud fra
calciumhydroxid, Ca(OH)2
og ammoniumchlorid, NH4Cl ?
Materialer:
- 2 reagensglas
- Måleglas, 10 ml
- Glasskål eller balje
- pH-papir
- Stativ
- Gasbrænder
- Tændstikker
- Calciumhydroxid, Ca(OH)2
- Ammoniumchlorid, NH4Cl
- Sikkerhedsbriller
Metode (udførelse):
 • Bland en halv teskefuld Ca(OH)2 og NH4Cl i et reagensglas. Tilsæt 5
ml vand. Opvarm blandingen med en gasbrænder. Da ammoniak er lettere end luft, stiger den til vejrs. Derfor kan
du opsamle ammoniakken i et reagensglas ved at holde det med bunden i vejret
over det opvarmede reagensglas. Hold et fugtigt pH-papir ind i ammoniakdampen
og mål pH:_____
• Bland en halv teskefuld Ca(OH)2 og NH4Cl i et reagensglas. Tilsæt 5
ml vand. Opvarm blandingen med en gasbrænder. Da ammoniak er lettere end luft, stiger den til vejrs. Derfor kan
du opsamle ammoniakken i et reagensglas ved at holde det med bunden i vejret
over det opvarmede reagensglas. Hold et fugtigt pH-papir ind i ammoniakdampen
og mål pH:_____
• Når reagensglasset er fyldt med ammoniak, sættes det med
mundingen nedad i glasskålen med vand. Hvad sker der med ammoniakken i
reagensglasset?
• Undersøg vandet, som ammoniakken er opløst i, med pH-papir. Hvad
er pH-værdien?____
Resultatbehandling:
Er ammoniakvand surt eller basisk?______
• Hvilke ioner dannes, når ammoniak opløses i vand.
Gør reaktionsligningen færdig.
NH3 + H2O → __________ + ____________
• Forklar reaktionen mellem ammoniumchlorid
og calciumhydroxid.
Færdiggør reaktionsligningen. Skriv først stoffernes ioner.
2 NH4Cl + Ca(OH)2 → 2 NH4 + _____ +_____+_____ →
_______ + _______ + 2 H2O
Forsøg 4a:
Bakterier og nitrat
Problemformulering:
Kan bakterier rense spildevand for nitrat ?
Materialer:
- Jord
- elkedel
- 2 stk. Konisk kolbe, 250 ml
- Gummiprop med hul
- gærrør
- Natriumnitrat, NaNO3
- Sukker
- folie
- Nitratstrimler
- Vægt
- Trefod med net
- Gasbrænder
Metode (udførelse):
• Kog 3-400 ml vand i en elkedel og hæld 200 ml i en konisk kolbe
og lad det afkøle. Tildæk kolben med et stk. folie. Tilsæt 20 mg natriumnitrat,
så nitratkoncentrationen er ca. 100 mg nitrat pr. liter. Afprøv med en
nitratstrimmel.
• Hæld 75 gram jord og 75 gram sukker i en konisk kolbe, og fyld
op med nitratopløsningen.
Rør rundt, til sukkeret er opløst.
• Sæt en gummiprop med hul i kolben og
et gærrør med vand i hullet.
I jorden er der nitratnedbrydende
bakterier. Når der ikke er oxygen til stede, omdanner bakterierne nitrat til luftformig nitrogen, N2. Det kaldes anaerob respiration. Der skal være organisk stof til stede.
Her har du brugt sukker. Det luftformige N2 siver ud af gærrøret.
• Foretag nitratmålinger gennem 14 dage med nitratstrimler. Brug
et filterpapir mellem strimmel og jordsuppen ! (spørg
læreren)
Notér
dine observationer i nedenstående skema.
Resultatbehandling:
|
|
|
|
|
|
|
|
|
|
|
Nitrat koncentration mg/l |
|
|
|
|
|
|
|
|
1)
Opskriv reaktionsligningen for bakteriernes almindelige respiration:
2)
Prøv nu at opskrive reaktionsligningen for bakteriernes anaerobe respiration (hjælp: erstat oxygen med nitrat)
3)
Hvad viser tallene i tabellen ovenfor ?
4)
Hvordan renser man spildevand for fosfat ?
Forsøg 4b:
Bakterier og nitrat
Problemformulering:
Kan bakterier omdanne Ammoniak til nitrat ?
Materialer:
- Bægerglas, 250 ml
- Ammoniakvand, NH4OH
- Plastfolie
- Nitrit- og nitratstrimler
- pH-papir, inddeling pH 4-7
eller pH-meter
- Kompostjord
Metode (udførelse):
• Hæld ca. 100 ml vand i et bægerglas, og tilsæt 10 ml
ammoniakvand.
• Drys ca. 100 ml jord i bægerglasset.
• Find værdier for pH, nitrit og nitrat i „jordsuppen“. Brug et
filterpapir mellem strimmel og jordsuppe ! (spørg
læreren)
• Dæk glasset med plastfolie. Foretag målinger efter én, to, tre
og fire uger.
Hver gang røres „jordsuppen“ igennem inden målingen.
Rør jævnligt rundt i „jordsuppen“, så den iltes.
Resultatbehandling:
|
dato |
pH |
Nitrit mg/l |
Nitrat mg/l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1)
Opskriv reaktionsligning for den kemiske reaktion.
2)
Hvad viser udviklingen i jordsuppen
?
3)
Beskriv N-kredsløbet og bemærk hvor dette forsøg
passer ind.
4)
Hvor i samfundet kan man bruge dette
?
Forsøg 5a:
Bakterier i jord
Problemformulering:
Hvor mange bakterier er der i jord ?
Materialer:
Spritbrænder
5 petriskåle med agar (YPG)
elkedel
sterilt vand
sterile pipetter (indpakkede)
7 sterile reagensglas med propper
kapillærrør.
Metode (udførelse):

 Alle
reagensglas steriliseres før forsøget ved skoldning med kogende vand (brug
elkedel), petriskåle og pipetter er sterile. Lad glassene stå med det kogende
vand i 3 min, hæld vandet ud og lad glassene køle ned.
Alle
reagensglas steriliseres før forsøget ved skoldning med kogende vand (brug
elkedel), petriskåle og pipetter er sterile. Lad glassene stå med det kogende
vand i 3 min, hæld vandet ud og lad glassene køle ned.
Lav en drigalskispater af et kapillærrør:
Reagensglassene nummereres 1-6
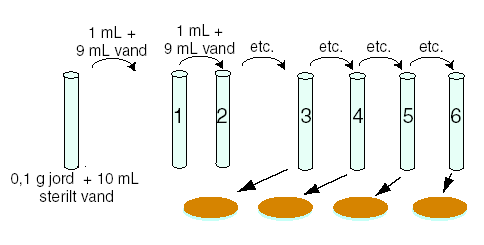
I et reagensglas (kaldet stamopløsningen) ”opløses” 0,1 g jordprøve i 10 ml steriliseret vand. Stamopløsningen rystes grundigt.
I
6 reagensglas afpipetteres 9 ml steriliseret
vand.
Fra
stamopløsningen (rystes først) overføres 1 ml til reagensglas nr. 1 og det
rystes. Dvs. at stamopløsningen nu er fortyndet 10 gange. Fra reagensglas nr. 1
overføres 1 ml til reagensglas nr. 2 og det rystes. I reagensglas 2 er
stamopløsningen fortyndet 100 gange. Proceduren gentages til og med reagensglas
nr. 6.

0,5
mL fra reagensglas nr. 3 overføres men en steril
pipette til en agarplade og fordeles jævnt ud over
pladen med en drigalskispatel og fortyndingsfaktoren
skrives på bunden. Det samme gøres med reagensglas nr. 4, 5 og 6. Før den
enkelte spredning med drigalskispatelen skal denne
steriliseres ved opvarmning over en bunsenbrænder
Den
5. agarplade er kontrol. Herpå fordeles 0,5 ml
steriliseret vand.
Agarplader stilles et lunt sted (30°C) med bunden
opad i to døgn (ved lavere temperatur skal agarpladerne
stå i længere tid). Derefter tælles kolonierne.
Resultatbehandling
|
Petriskål |
3 |
4 |
5 |
6 |
7 |
|
Antal kolonier |
|
|
|
|
|
Vælg en plade hvor koloniantallet ligger mellem 25 og 250. Beregn derefter hvor mange bakterier der var i de 0,1 g jord i udtog.
Beregn bakteriekoncentrationen i bakterier/g
Forsøg 5b:
Iltsvind
Problemformulering:
Er nitrat årsag til iltsvind
?
Materialer:
Alger
3 små plast-reagensglas (grønt låg)
Flydende NPK gødning
Pipette
Metode (udførelse):
Fyld 3 ml Algeopløsning i hvert reagensglas.
Mærk reagensglassene 0, 1 og 2.
Tilsæt 1 dråbe npk
gødning til glas 1 og 2 dråber til glas 2.
Prik hul i låget på glassene og lad
glassene stå nogle uger.
Resultatbehandling:
1)
Hvad viser udviklingen i glassene ?
2)
Hvorfor giver algevæksten iltsvind i hav og søer ?